口腔内的绝大多数微生物以牙菌斑生物膜的 形式存在,与浮游菌相比,菌斑生物膜内细菌的毒 力、耐药性和抵抗机械清除的能力均更强,且 使 用机械方法不能完全清除菌 斑 生 物 膜,因此需要联 合抗菌剂进一步控制菌斑。目前临床上最常用和最有 效的抗生素制剂是氯己定 (chlorhexidine,CHX), 但存在降低味觉敏感性、口腔组织色素沉着等副作 用,因此需要寻找长效和副作用比较少的药物来控 制菌斑。
1 材料与方法
1.1 药物及试剂
1.1.1 苦参提取物制备
药物来源:新疆医科大学 天然药物研究重点实验室提供,取干燥苦参药材适 量粉碎过60目 筛,按 照 料 液 比1∶10 (g/mL)溶 于蒸馏水中,于摇床上浸泡20min后放入超声振荡 仪中 (80 ℃、100%的功率下45min),抽滤,将滤 渣进行2次提取,合并2次滤液;将滤液旋转蒸发 浓缩并冷冻干燥 (-80 ℃),得黄白色粉末,用 蒸馏水配制母液浓度为64mg/mL,过0.22μm 无 菌滤过器避光储存于4 ℃冰箱备用。
1.1.2 实 验 试 剂
脑 心 浸 液 培 养 基 (brainheart infusion,BHI),美国 BD 公司,Lot号:7075659; 氯化血 红 素,上 海 源 叶 生 物 科 技 有 限 公 司,CAS 号:16009-13;维 生 素 K1 注 射 液,遂 成 药 业 股 份 有限公 司,国 药 准 字 号:H41021051;蔗 糖,天 津永晟精细化工有限公司,HG/T 号:3462-1999;结 晶紫,Solarbio,CAS 号:548-62-9;厌 氧 产 气 袋, 型号:CX-35,厌氧指示剂,型号:CX-22,日本三 菱瓦斯化学株式会社。
1.2 实验
菌 株、培养基和实验分组 变 形 链 球 菌 (Streptococcusmutans,UA159)、远缘链球菌 (Strep- tococcussobrinus,ATCC6715)、血链球菌 (Streptococ- cussanguis,ATCC10556)、粘性放线菌 (Actinomyces viscosus,ATCC 19246)、内 氏 放 线 菌 (Aetinomyces naeslundii,ATCC12104)和嗜酸乳杆菌 (Lactobacil- lusacidophilus,ATCC4356)购买于美国模式培养物 集存库 (Americantypeculturecollection)。将标准菌株 接种 于 3 mL 液 体 培 养 基 中,80% N2、20% CO2、 37℃恒温培养箱培养48h,将各复苏菌株接种于BHI 或 MRS琼脂平板上,80% N2、20% CO2、37℃厌氧 培养24h,涂片检查为纯培养后,分光光度计调定菌 悬液浓度分别为浮游菌实验为106 CFU/mL (A600 = 0.2)、生物膜实验为107 CFU/mL (A630=0.2)。用 含 1%蔗糖的BHI或 MRS液体培养基将母液按二倍梯 度稀释法稀释作为实验组;不加药液的培养基为阴 性对照组 (negativecontrolgroup,NC);0.5g/L 的 CHX为阳性对照组。
1.3 仪器
洁净工作台,上海博迅实业有限公司医疗设备厂;紫外可见分光光度计,上海棱光技术有 限公司;Bio-rad酶 标 仪,美 国 伯 乐;密 封 培 养 罐, 日本三菱瓦斯化学株式会社;电热恒温培养箱,上 海一恒科技有限公司;电子天平,METTLERTO- LEDO;EYELA 冷 却 水 循 环 装 置,油 浴 锅,EYE- LA 旋转蒸发仪;离心机,Sigma。
1.4 方法
1.4.1 苦参提取
物 对 浮 游 菌 生 长 抑 制 试 验 根 据 Wiegand等研 究 方 法,于 无 菌 试 管 中 分 别 加 入 1mL菌悬 液 及 1 mL 梯 度 稀 释 含 药 培 养 基,80%N2、20% CO2、37 ℃ 培 养 24h,在 黑 背 景 下,以 肉眼观察未见浑浊的最低药物浓度为药物的最低抑 菌浓度 (minimuminhibitionconcentration,MIC), 将未浑浊的试管中的培养基分别接种于琼脂固体培 养皿上,37 ℃厌氧培养24h,观察细菌 生 长 情 况, 无细菌生长的最低药物浓度为该药的最低杀菌浓度 (minimumbactericidalconcentration,MBC)。
1.4.2 苦参提取物对浮游菌黏附抑制试验
细菌黏 附试验采用分光光度比浊法测定,于无菌试管中 分别加入1mL的菌悬液,再分别加入2mL1 MIC 值以下的4个药物浓度 (包含1MIC),将试管与水 平 面 成 30°放 置,80% N2、20% CO2、37 ℃ 培 养 24h。将培养好的试管 (试管1)轻柔旋转3圈后, 菌液倒入另一无菌试管 (试管2),从试管1无黏附 侧加入3mL磷酸盐缓冲溶液 (phosphatebuffersa- line,PBS),轻柔 旋 转3圈 后,洗 脱 液 倒 入 另 一 无 菌试管 (试管3),试管2和3分别8000r/min (离 心半径8cm,下同)离心15min,弃上清液,在试 管1、2和3中分别加入3mLPBS缓冲液,震荡混 匀。使用紫外分 光 光 度 计 在540nm 处,以 PBS缓 冲液为空白对照组,测定各试管的吸光度 (A)值, 实验重复3次取平均值。细菌黏附比=A1/ (A1 +A2 + A3)×100%,黏附抑制 率= (阴性对照组黏附率-实 验 组 黏附率)/阴性对照组黏附率×100%。
1.4.3 苦参提取物对浮游菌产酸抑制试验
1 MIC 值以下的4个苦参提取物药物浓度 (包含1 MIC), 按体积比为10∶1接种等量菌悬液于无菌试管 中, 调定其初始 pH=7.0,80% N2、20% CO2、37 ℃ 培养24h 后 于 冷 冻 离 心 机 8000r/min4 ℃ 离 心 30min,电子pH 计 测 定 上 清 液 pH 值,实 验 重 复 3次。ΔpH=初始pH 值-终末pH 值。
1.4.4 苦 参 提 取 物
对 浮 游 菌 水 不 溶 性 胞 外 多 糖 (exopolysaccharides,EPS)抑制试验 按照苯酚- 硫酸法测定葡聚糖标准曲线。细菌干预步骤同 1.4.3,培养24h后于冷冻离心机8000r/min4 ℃ 离心30min,弃上清 液,各 加 入5.0mL 无 菌 水 洗 涤,离心2次 (12000r/min,4 ℃,30 min),水 洗后的 沉 淀 用 0.1 mol/L NaOH 重 悬,离 心 2 次 (12000r/min,4 ℃,30 min),合 并 上 清 液,过 0.22μm 硝酸纤维素滤膜,加入3倍体积冷95%乙 醇溶液,4℃下过夜沉淀EPS,加入冷5%苯酚、浓 硫酸和 EPS溶液 (体积比为1∶5∶1),于490nm 处测A 值,实验重复3次。
1.4.5 苦参提取物对单菌生物膜的抑制试验
96孔 板中分别加入实验菌悬液50μL和150μL已梯度稀释的 含 药 培 养 基, 封 口 膜 密 封, 摇 床 震 荡 培 养 30min后80% N2、20% CO2、37 ℃培养24h,吸 出96孔板 中 上 清 液,无 菌 PBS 洗 2 次 去 浮 游 菌, 4%多聚甲醛固定15min后用鼓 风 干 燥 箱 干 燥,加 入0.1%结晶紫染色5min,PBS每孔清洗3次,室 温下干燥,每孔加入200μL95%乙醇,于微量振荡 器上 震 动 30 min,将 乙 醇 复 吸 至 另 一 96 孔 板 中, 用酶标仪在A595nm处读数,实验重复3次。抑 制 率= (A595阴 性 对 照组 - A595实 验组 )/A595阴 性 对 照 组 × 100%; MBIC80 (80% ofminimumbiofilminhibitionconcentration, MBIC80)为抑制80%以上的生物膜形成的最低药物 浓度。
1.4.6 苦参提取物对单菌生物膜最低清除浓度的试验
96孔板中分别加入实验菌悬液50μL和液 体培养基150μL,37 ℃厌氧培养24h形成生物膜。 吸出96孔板中上清液,PBS洗去浮游菌后加入已梯 度稀释的200μL 含 药 液 体 培 养 基 进 行 干 预。方 法 一:37 ℃ 厌 氧 培 养 24 h, 其 余 步 骤 同 1.4.5, MBEC 为 A 值 突 然 升 高 前 的 临 界 值。 方 法 二: 37 ℃厌氧培养24h后,将培养液接种于 BHI琼脂 培养皿 上,37 ℃厌 氧 培 养24h,观 察 细 菌 生 长 情 况,无细菌 生 长 的 最 低 药 物 浓 度 为 该 药 的 MBEC, 实验重复3次。
1.4.7 苦参提取物对单菌生物膜产酸抑制试验
将 直径15mm 无菌细胞培养盖玻片置入24孔 细 胞 培 养板 中,每 孔 加 入 500μL 菌悬液和液体培养基 1500μL,37℃厌氧培养24h形成生物膜;吸出上 清液,无菌 PBS洗2次去浮游菌,加入已梯度稀释 的2000μL 含 药 液 体 培 养 基 (pH=7.0) 干 预, 37 ℃厌氧培养 24h 后 吸 出 24 孔板内的培养基于 2mLEP管中,其余实验步骤同1.4.3,测pH 值; 实验重复3次。
1.4.8 苦参提取物对单菌生物膜水不溶性
EPS抑 制试 验 药 物 干 预 生 物 膜 的 实 验 步 骤 同 1.4.7, 37 ℃厌氧培养24h后吸出24孔板内的培养基,无 菌 PBS洗2次去浮游菌,用无菌刀片将菌膜轻轻刮 至 2.0 mL EP 管 中, 无 菌 水 洗 涤, 其 余 步 骤 同 1.4.4,测A 值;实验重复3次。
2 结 果
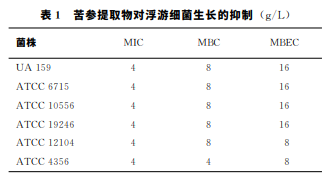
6种细菌的 MIC值均为4g/L,嗜 酸 乳 杆 菌 的 MBC 为4g/L, 其余5种细菌均为8g/L。见表1。
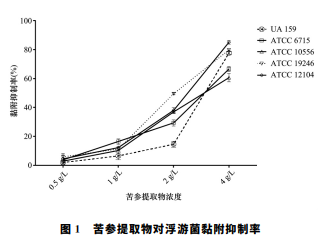
苦参提取物 在浓度为2g/L时表现出明显的抑制,变形链球菌 (F=968.4,P<0.001)、远缘链球菌 (F=470.5, P<0.001)、血 链 球 菌 (F=429.3,P<0.001)、 粘性放线菌 (F=2224.0,P<0.001)和内氏放线 菌 (F=904.9,P<0.001),并在1 MIC 时对上述 细菌的黏附抑制 率分别为 (77.6% ±1.2%)、 (66.7%±1.8%)、(60.68%±2.9%)、(79.8%±1.2%)和 (85.1% ±1.3%),浓 度 在 0.5g/L 和 1g/L时对变形链球菌的黏附抑制差异没有统计学意 义 (P=0.084),其 他 各 组 内 比 较 差 异 均 有 统 计 学 意义 (P<0.05),见图1。
3 讨 论
通过本实验发现苦参提取物对主要 致龋细菌的 MIC为4g/L,在此浓度下抑制口腔主 要致龋菌黏附率达60%以上,并明显抑制浮游细菌 产酸及合成水不溶性 EPS。在1 MIC浓度下能明显 抑制主要致龋细菌的单菌生物膜形 成能力并优于 0.5g/LCHX;2 MIC 浓度下对变形链球菌和内氏 放线菌的单 菌 生 物 膜 清 除 能 力 优 于0.5g/LCHX, 达到70%左右,而其余细菌是在4MIC浓度下单菌 生物膜的清除能力优于0.5g/LCHX,达到80%以 上。在1MIC浓度下均能抑制单菌生物膜产酸和合成 水不溶性EPS,2MIC浓度下明显抑制单菌生物膜产 酸和合 成 水 不 溶 性 EPS,抑制 率 分 别 为 64.5% ~ 94.1%和42.3%~60.0%。